Screening e Diagnosi Anomalie Genetiche e Cromosomiche
Screening Preeclampsia
Translucenza Nucale - Bi-Test - DNA fetale (NIPT) - Villocentesi - Amniocentesi - Preeclampsia
Le ANOMALIE GENETICHE su base genica (emofilia, distrofia muscolare, fibrosi cistica etc.) sono relativamente rare nella popolazione e pertanto rappresentano quantitativamente una piccola parte delle richieste di diagnosi prenatale.
Pertanto, gran parte delle richieste per diagnosi prenatale ha come obiettivo di escludere le ANOMALIE CROMOSOMICHE. Circa 1 bambino su 300 ha una anomalia cromosomica, cioè; una alterazione del numero o della struttura dei propri cromosomi, la più nota e frequente delle quali è la Sindrome di Down (Trisomia 21), seguita dalla Trisomia 18 (Sindrome di Edwards), Trisomia 13 (Sindrome di Patau), Sindrome di Klinefelter (47,XXY), Sindrome di Turner (45,X), etc. La Sindrome di Down rappresenta una delle prime cause congenite di ritardo mentale.

La Diagnosi Prenatale
Per DIAGNOSI PRENATALE si intende l’insieme delle indagini cliniche, strumentali e di laboratorio volte a monitorare lo stato di salute e di benessere del feto durante il corso della gravidanza. Le diverse tecniche impiegate sono finalizzate ad identificare patologie che interessano il feto su base genetica, cromosomica, infettiva, iatrogena o ambientale.
I principali obiettivi della diagnosi prenatale sono i seguenti:
- Rassicurare la gestante e la coppia sul decorso della gravidanza e sullo stato di benessere del bambino in utero;
- Fornire informazioni dettagliate alle coppie, soprattutto quelle a rischio per patologie congenite;
- Permettere di ottimizzare la condotta medica, ostetrica, psicologica e postnatale di fronte all’eventuale anomalia fetale evidenziata.
L’attività di diagnosi prenatale prevede un approccio globale alla gravidanza avvalendosi dell’ecografia (metodica ”fulcro” di tale branca specialistica dell’ostetricia) ma anche colloqui, test e metodiche invasive, tutte finalizzate alla diagnosi e all’individuazione del rischio di malformazioni e anomalie fetali.
Anomalie e Malformazioni
Circa il 3% dei neonati è affetto da una malattia o anomalia congenita. In molti casi questa può essere prevista, diagnosticata, trattata o prevenuta attraverso la conoscenza e l’identificazione dei fattori di rischio che ne sono alla base e l’adozione di opportune tecniche di indagine. La diagnosi prenatale comprende appunto l’insieme delle procedure che permettono la diagnosi precoce:
a) delle malattie genetiche su base genica;
b) delle anomalie cromosomiche;
c) delle malformazioni fetali rilevabili “in utero” nel corso della gravidanza.
Le anomalie genetiche su base genica (emofilia, distrofia muscolare, fibrosi cistica etc.) sono relativamente rare nella popolazione e pertanto rappresentano quantitativamente una piccola parte delle richieste di diagnosi prenatale.
Le malformazioni congenite colpiscono circa il 2% dei neonati, alterano l’anatomia degli organi del concepito e spesso possono essere riconosciute attraverso un’accurata ecografia morfologica, eseguita nel corso del secondo trimestre.
Pertanto, gran parte delle richieste per diagnosi prenatale ha come obiettivo di escludere le anomalie cromosomiche. Circa 1 bambino su 300 ha una anomalia cromosomica, cioè; una alterazione del numero o della struttura dei propri cromosomi, la più nota e frequente delle quali è la Sindrome di Down (Trisomia 21), seguita dalla Trisomia 18 (Sindrome di Edwards), Trisomia 13 (S. di Patau), S. di Klinefelter (47,XXY), S. di Turner (45,X), etc. La Sindrome di Down rappresenta una delle prime cause congenite di ritardo mentale.
Gli Screenings
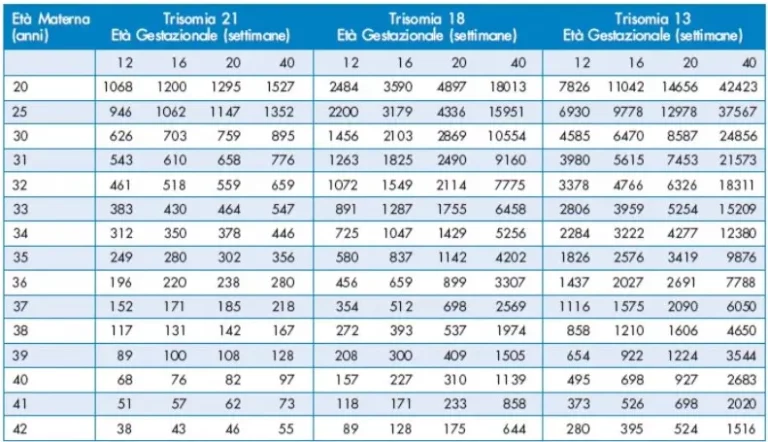
Il primo test di screening per le cromosomopatie e in particolare per la sindrome di Down si è basato sull’osservazione dell’associazione fra ETÀ MATERNA e nascita di bambini affetti; tuttavia tale tipo di screening ha dimostrato una scarsa efficacia a causa del fatto che non riesce ad identificare più del 25-30% delle gravidanze affette
Nessuna età materna è, infatti, risparmiata dal rischio di avere prole con anomalie cromosomiche sebbene questo rischio aumenti significativamente con l’aumentare dell’età. Infatti, la maggior parte dei bambini con Sindrome di Down (70-75%) nasce da madri con età inferiore ai 35 anni, essendo la maggior parte di queste quelle che non si sottopongono alle indagini di diagnosi prenatale sulle cellule fetali.
Tuttavia numerose anomalie cromosomiche (Sindrome di Turner, Sindrome di Klinefelter e altre anomalie dei cromosomi sessuali) presentano un rischio non legato all’età materna.
In una donna con un precedente feto o bambino affetto da una trisomia, il rischio di ricorrenza nella gravidanza successiva è dello 0.75% maggiore rispetto al rischio dato dalla sola età materna. Precedenti gravidanze con neonati sani non abbassano il rischio a priori di avere in futuro figli affetti da anomalie cromosomiche.
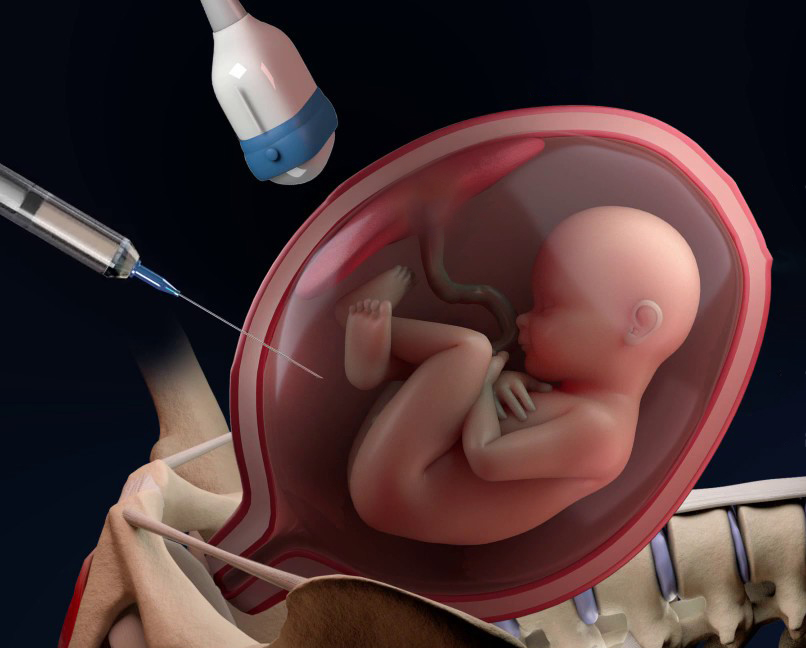
La certezza diagnostica che un feto sia affetto da un’anomalia cromosomica o genetica è ottenibile soltanto esaminando le sue cellule attraverso il prelievo dei villi coriali (VILLOCENTESI) o del liquido amniotico (AMNIOCENTESI), seppure a fronte di un rischio aggiuntivo di aborto causato da queste procedure che si attesta intorno allo 0.5-1%. Lo scopo principale di queste indagini è quello di esaminare le cellule al fine di effettuare l’esame del cariotipo fetale, cioè l’analisi della struttura e del numero dei cromosomi fetali. Inoltre, mediante tali procedure è possibile indagare anche numerose malattie genetiche per le quali sia note la mutazione o le mutazioni responsabili.


Test Combinato del I Trimestre - Translucenza Nucale + Bi-test
Tra le 11+0 giorni e le 13 settimane+6 giorni, si esegue un’ecografia di screening per valutare il rischio individuale di sindrome di Down e di altre malattie cromosomiche. Nel corso di questa ecografia viene misurata la TRANSLUCENZA NUCALE (NT) che corrisponde ad un accumulo di fluido dietro la nuca del bambino. La misurazione della translucenza nucale richiede l’utilizzo di ecografi di alto livello e di ultima generazione, utilizzati da personale adeguatamente addestrato, certificato e sottoposto a verifica annuale dell’appropriata esecuzione da parte della Fetal Medicine Foundation (FMF) di Londra. L’aumento della NT, permette inoltre di identificare un’elevata proporzione di altri difetti cromosomici ed è inoltre associato ad anomalie del cuore e ad un vasto gruppo di sindromi genetiche. Il Bi-Test è il dosaggio di due sostanze presenti nel sangue materno: Free-β-hCG (frazione libera della gonadotropina corionica) e PAPP-A (proteina A plasmatica associata alla gravidanza). La sensibilità dell’esame è di circa il 90% e i falsi positivi del 5%.
Il calcolo del rischio statistico viene effettuato da un software, fornito dalla FMF solo agli operatori e ai laboratori accreditati, che prende in considerazione, oltre alla translucenza nucale ed al bi-test, la presenza/assenza dell’osso nasale fetale, la frequenza cardiaca fetale, l’eventuale alterazione del flusso attraverso la valvola cardiaca tricuspide fetale e nel dotto venoso di Aranzio e la presenza di anomalie strutturali fetali. Inoltre il calcolo viene reso “individualizzato” sulla base dell’età materna e dell’epoca gestazionale fetale, del numero di precedenti gravidanze interrotte o portate a termine, dell’etnia, del peso corporeo, del fumo, della presenza di diabete o ipertensione, della positività anamnestica per precedenti figli con anomalie cromosomiche.
Tutte le linee guida nazionali ed internazionali raccomandano che il medico che esegue la misurazione della Translucenza Nucale sia accreditato presso la Fetal Medicine Foundation di Londra. Ciò è di fondamentale importanza sia per garantire una corretta misurazione che per essere sicuri che il test venga repertato nel modo corretto. Potete verificare i medici accreditati al seguente link: https://fetalmedicine.org/lists/map/certified/.
Inoltre, è possibile effettuare contestualmente lo screening per la PREECLAMPSIA.
Test del DNA Fetale - NIPT
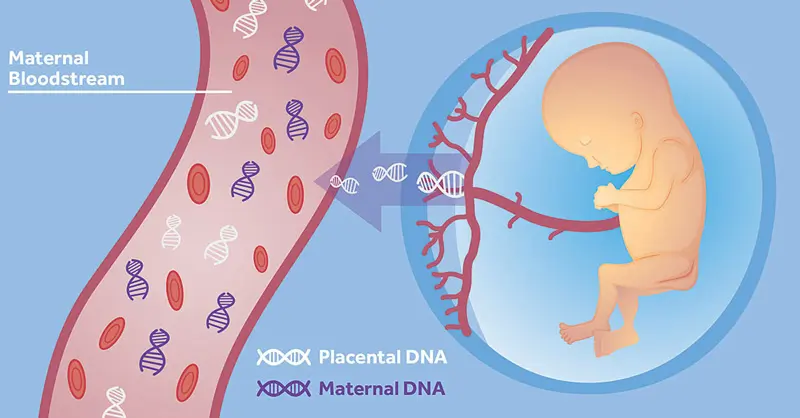
I test che si basano sulla valutazione del DNA fetale circolante nel sangue materno sono indagini non invasive (NON INVASIVE PRENATAL TEST – NIPT) che permettono di valutare il rischio di alcune patologie fetali quantificando la frazione di DNA fetale circolante nel sangue materno. Si esegue con un semplice prelievo ematico alla gestante a partire dalla 10a settimana di gestazione. Questi esami sono molto sensibili e rappresentano quanto di meglio disponibile per la valutazione del rischio di aneuploidie relative ai cromosomi 21, 18, 13 ed ai cromosomi sessuali (X e Y). La predittività per Sindrome di Down si aggira intorno al 99% con un tasso di falsi positivi inferiore allo 0.3%. Inoltre, importanti evoluzioni hanno consentito di estendere la valutazione anche alle aneuploidie di tutti gli altri cromosomi fetali nonchè ad individuare alcune alterazioni cromosomiche strutturali come alcune sindromi da microdelezione (ad es. la S. di Di George, S. Cri-du-chat, S. di Prader-Willi, S. di Angelman, etc.).
Lo screening della sindrome di Down mediante ricerca del DNA fetale (NIPT) sul sangue materno dovrebbe essere effettuato contestualmente all’ecografia del I trimestre in modo tale da valutare in epoca precoce alcuni importanti aspetti dell’anatomia fetale (preferibilmente tra 12 e 14 settimane).
Il Ministero della Salute raccomanda nelle “Linee-Guida Screening prenatale non invasivo basato sul DNA (Non Invasive Prenatal Testing – NIPT) (Maggio 2015) che chiunque eroghi il test debba:
- Avere competenze nella diagnosi ecografica
- Avere competenze nella diagnosi prenatale
- Essere in grado di fornire la consulenza pre-test e post-test
- Essere collegato a laboratori che rispondono ai seguenti requisiti:
- essere certificati
- partecipare a programmi di controllo della qualità, nazionali ed internazionali
- essere dotati di personale con competenza specifica nelle tecniche di NGS.
La marchiatura CE-IVD del test di screening per la valutazione del rischio di trisomia 21 è un obbligo di legge sia per i fabbricanti dei dispositivi, sia per gli operatori sanitari che offrono tali test (Direttiva 98/79/CE – D.L. 8 sett. 2000, n. 332).
I test basati sul DNA fetale non dovrebbero essere offerti come test routinari nelle gravidanze gemellari. Lo screening mediante DNA può trovare, inoltre, indicazione nelle donne classificate ad alto rischio per i seguenti motivi: età materna > 35 anni; elementi ecografici suggestivi di incrementato rischio per aneuplodie; precedente gravidanza con trisomia; positività per aneuplodie in altri test.
Inoltre, è possibile effettuare contestualmente lo screening per la PREECLAMPSIA.





Test per rischio PREECLAMPSIA
Lo screening a 11-13 settimane identifica un gruppo ad alto rischio di pazienti che possono sviluppare PREECLAMPSIA (PE), in queste pazienti la somministrazione di aspirina può sostanzialmente ridurre l’incidenza di tale temibile complicanza.
La PE è una sindrome multisistemica che si sviluppa nella seconda metà della gravidanza nel 2-5% dei casi. É caratterizzata dalla presenza di ipertensione e/o proteinuria oppure da segni di compromissione di altri organi.
La PE è una delle principali cause di mortalità materna e perinatale o di disabilità. Più di 50,000 morti materne ogni anno in tutto il mondo sono attribuite alla PE. Le complicanze più severe che possono portare a morte materna sono l’eclampsia (convulsioni o coma in una donna con PE), emorragia cerebrale o ictus, coagulazione intravascolare disseminata (CID) e HELLP syndrome (Hemolysis, Elevated Liver enzymes and Low Platelets). Altre complicanze severe includono edema cerebrale, cecità, insufficienza renale, insufficienza epatica ed edema polmonare.
La PE è associata, inoltre, a una diminuita perfusione placentare con conseguente ridotta crescita fetale e ridotta ossigenazione ed aumentato rischio di morte endouterina. Inoltre, un’alta percentuale di donne affette da PE va incontro ad un parto prematuro per indicazione materna e/o fetale, esponendo così i neonati agli ulteriori rischi legati alla prematurità. La PE e l’eclampsia sono responsabili di circa il 25% delle morti endouterine e neonatali e del 15% di ridotta crescita neonatale.
L’obiettivo dello screening per la PE a 11-13 settimane di gravidanza è identificare i casi che trarrebbero beneficio dall’uso profilattico di aspirina che riduce il rischio di PE pretermine di più del 60% dei casi.
L’uso profilattico di aspirina a basse dosi entro 16 settimane nelle pazienti risultate ad alto rischio determina una riduzione dell’incidenza di PE pretermine del 62% e una riduzione dell’incidenza di PE <34 settimane dell’82% – studio ASPRE del 2017 (Combined Multimarker Screening and Randomized Patient Treatment with Aspirin for Evidence-Based Preeclampsia Prevention).
Il test per predire la PE si basa su un calcolo computerizzato che considera caratteristiche materne (età, peso, altezza, razza, precedenti gravidanza, ipertensione, diabete, lupus eritematoso, fecondazione in vitro, storia personale o familiare di PE), misurazione della pressione arteriosa materna, ecografia per la valutazione del bambino e Doppler-flussimetria delle arterie uterine e il dosaggio dal sangue materno della PIGF (Fattore di Crescita Placentare).


Prelievo dei Villi Coriali - Villocentesi
Lo scopo principale del prelievo dei villi coriali le cellule “placentari” nei villi coriali al fine di effettuare l’esame del cariotipo fetale, cioè l’analisi della struttura e del numero dei cromosomi fetali. Si esegue tra 11 e 13 settimane di gravidanza.
Il rischio d’aborto legato a questa procedura rappresenta un rischio “aggiuntivo” rispetto a quello naturale di abortività spontanea e che è di circa lo 0.5 – 1%.
L’esito dell’analisi dei villi coriali è disponibile generalmente in 7 giorni con l’analisi “diretta” e in 15-21 con quella “colturale”. Quindi, in caso di alterazioni cromosomiche importanti, eventuali interruzioni della gravidanza potranno essere eseguite secondo i termini previsti della Legge (194/78).
Il risultato dell’esame è altamente attendibile raggiungendo circa il 99,7 %. Attualmente è possibile incrementare l’efficacia diagnostica di questo esame mediante il ricorso al “cariotipo molecolare” (CGH Array): tecnica molecolare, che non necessita di coltura cellulare, con la quale è possibile ottenere un’analisi cromosomica approfondita in circa 7 giorni. Il cariotipo molecolare consente di identificare alcune patologie derivanti da alterazioni cromosomiche submicroscopiche (microdelezioni e le micro duplicazioni), non evidenziabili tramite il cariotipo tradizionale, aumentando sensibilmente l’accuratezza dell’esame, pertanto è fortemente raccomandato.
Su richiesta della paziente e/o dove suggerito da specifici fattori di rischio, è possibile eseguire analisi geniche come la ricerca per la sindrome di Martin-Bell (o X-fragile) che è, tra le malattie dovute ad alterazioni geniche, la forma più frequente di ritardo mentale, la emoglobinopatie (es.:β-talassemia), alcuni tipi di sordità congenita e la distrofia muscolare di Duchenne. La richiesta di indagini aggiuntive, in genere, non comporta un prelievo maggiore di villi coriali e non comporta rischi aggiuntivi.
Il prelievo dei villi coriali e l’amniocentesi consentono di diagnosticare la maggior parte degli stessi difetti. La villocentesi consente di ottenere dei risultati più precocemente e più rapidamente rispetto all’amniocentesi.
La villocentesi si esegue introducendo un sottile ago attraverso l’addome materno, sotto guida ecografica, nel contesto del tessuto placentare, per prelevare una quantità sufficiente di villi coriali. L’esame viene eseguito sotto stretto controllo ecografico per tutta la sua durata di pochi minuti.
Amniocentesi
Lo scopo principale del prelievo di liquido amniotico è quello di esaminare le cellule nel liquido amniotico al fine di effettuare l’esame del cariotipo fetale, cioè l’analisi della struttura e del numero dei cromosomi fetali. Si esegue dopo la 15a settimana di gravidanza.
Il rischio di aborto legato a questa procedura rappresenta un rischio “aggiuntivo” rispetto a quello naturale di abortività spontanea e si aggira intorno allo 0.5 – 1%.
L’esito dello studio sul liquido amniotico si ha dopo circa tre settimane. Quindi, in caso di alterazioni cromosomiche importanti, eventuali interruzioni della gravidanza potranno essere eseguite secondo i termini previsti della Legge (194/78).
Il risultato dell’esame è altamente attendibile raggiungendo circa il 99,7 %. Attualmente è possibile incrementare l’efficacia diagnostica di questi esami mediante il ricorso al “cariotipo molecolare” (CGH Array): tecnica molecolare, che non necessita di coltura cellulare, con la quale è possibile ottenere un’analisi cromosomica approfondita in circa 7 giorni. Il cariotipo molecolare consente di identificare alcune patologie derivanti da alterazioni cromosomiche submicroscopiche (microdelezioni e le micro duplicazioni), non evidenziabili tramite il cariotipo tradizionale, aumentando sensibilmente l’accuratezza dell’esame, pertanto è fortemente raccomandato.
Su richiesta della paziente e/o dove suggerito da specifici fattori di rischio, è possibile eseguire analisi geniche come la ricerca per la sindrome di Martin-Bell (o X-fragile) che è, tra le malattie dovute ad alterazioni geniche, la forma più frequente di ritardo mentale, la emoglobinopatie (es.:β-talassemia), alcuni tipi di sordità congenita e la distrofia muscolare di Duchenne. La richiesta di indagini aggiuntive, in genere, non comporta un prelievo maggiore di liquido amniotico e non comporta rischi aggiuntivi.
L’amniocentesi si esegue introducendo un sottile ago attraverso l’addome materno, sotto guida ecografica, in una tasca di liquido amniotico precedentemente scelta. Si prelevano circa 20 ml di liquido amniotico. Il liquido amniotico, in questa epoca gestazionale, è costituito principalmente da urina fetale quindi, il volume iniziale verrà ripristinato entro circa 1 ora dal prelievo, con la successiva minzione fetale. L’esame viene eseguito sotto stretto controllo ecografico per tutta la sua durata di pochi secondi.